Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое МЕТАЛЛОВЕДЕНИЕ ФИЗИЧЕСКОЕ: ДИАГРАММЫ РАВНОВЕСИЯ - определение
Константа равновесия реакции; Константа химического равновесия; Показатель константы равновесия
Найдено результатов: 98
МЕТАЛЛОВЕДЕНИЕ ФИЗИЧЕСКОЕ: ДИАГРАММЫ РАВНОВЕСИЯ
К статье МЕТАЛЛОВЕДЕНИЕ ФИЗИЧЕСКОЕ
Представление об устойчивой комбинации фаз для материалов определенного состава при данных температуре и давлении восходит к американскому физику Дж.У.Гиббсу (1839-1903). Гиббс пришел к выводу, что, в принципе, даже химически чистый элемент может образовывать ряд различных кристаллических структур. Структура с самой низкой энергией образуется при равновесии. Понятие об этой энергии, получившей название энергии Гиббса (G), базируется на двух дополнительных понятиях - энтальпии и энтропии.
Энтальпия H единицы массы металла может мыслиться как сумма энтальпий всех связей между соседними парами атомов этой массы. Энтальпия зависит от кристаллической структуры, потому что и число атомных пар, и расстояния между соседними атомами изменяются от структуры к структуре. (Принято считать, что самая прочно связанная совокупность атомов имеет самую низкую энтальпию.)
Однако металл не обязательно будет образовывать структуру с самой низкой энтальпией при всех температурах. Это обусловлено тем, что тепловые колебания атомов влияют на прочность связи: чем выше температура, тем больше амплитуда колебаний и слабее связь. Величина этих колебаний выражается через энтропию S, которую удобно представлять как меру беспорядка. Энергия Гиббса G дается соотношением G = H - TS, где T есть абсолютная температура (измеряемая в градусах Кельвина). В твердом растворе (см. выше) энтропия зависит не только от тепловых колебаний атомов, но также от числа способов, которыми различные атомы могут быть распределены в кристаллической структуре. Это число характеризует беспорядок и увеличивается с ростом концентрации твердого раствора. Такой статистический аспект энтропии играет исключительно важную роль при определении равновесия системы сплава. Когда температура возрастает, материал становится существенно неупорядоченным. Близкая параллель может быть найдена в статистической энтропии эластичного полимера, которая является источником его сопротивления растяжению. Когда первоначально изогнутые полимерные цепи распрямляются, число возможных конфигураций уменьшается, и цепи теряют энтропию.
Соотношение G = H - TS и вывод Гиббса о том, что самое низкое возможное значение G определяет, какая кристаллическая структура является устойчивой, обусловливают тот факт, что энтальпия и энтропия в физическом металловедении находятся в состоянии постоянной конкуренции. Диаграмма равновесия показывает, как рассчитывается эта конкуренция для двух и более металлов при разных их пропорциях и температурах. Рассмотрим диаграммы равновесия для некоторых систем сплавов, чтобы лучше уяснить изложенные принципы.
Система серебро - магний. Диаграмма равновесия для этой комбинации металлов показана в нижней части рис. 3. По вертикальной оси откладывается температура, а по горизонтальной - доля атомов магния в серебре. На диаграмме можно выделить пять однофазных областей: при высоких температурах, жидкость; при более низких температурах, область ?, зона граничных твердых растворов, основанных на кубической кристаллической структуре серебра, характеризующейся плотной упаковкой; область ?, основанная на гексагональной кристаллической структуре магния, характеризующейся плотной упаковкой; область . ?, (бертоллидное) интерметаллическое соединение AgMg с простой кубической структурой из атомов Ag в вершинах кубов и атомов Mg в их центрах; наконец, фаза ?, более узкая бертоллидная область, соответствующая соединению AgMg3, структура которого имеет более сложную гексагональную элементарную ячейку. Эти однофазные области разделены двухфазными областями, в которых сосуществуют смежные фазы с составами, определяемыми границами с соседями, и изменяющиеся с температурой, причем относительные пропорции зависят от точки в пределах области, которая определяет температуру и общий состав. (Так, точка P определяет сплав с 0,6 долей атомов Mg, находящихся в равновесии при 600 К, т.е. 327. С.) Такой сплав иллюстрирует тот факт, что общий состав сплава совершенно отличен от состава равновесных фаз, если их две или более.
Обычно расплав сплава не может затвердевать без изменения в составе. Поэтому, когда расплав состава A достигает линии ликвидуса, он начинает затвердевать в составе B, определяемом линией солидуса. Этот процесс изменяет состав остальной части расплава, обогащая его магнием, так что последующее затвердевание происходит при постепенно снижающихся температурах, образуя твердое тело непрерывно изменяющегося состава. Такой сплав имеет неравномерный состав, определяемый смещающимся равновесием в процессе его затвердевания. Если охлаждение происходит медленно, то миграция атомов в горячем твердом теле успевает выровнять состав сплава; при быстром охлаждении равновесие не успевает установиться. Это простой пример метастабильной структуры.
Интерметаллическое соединение AgMg затвердевает "гармонично" - без изменения состава, т.е. можно сказать, что ликвидус и солидус при этом составе сплава совпадают; зачастую это служит для определения идеального состава бертоллида. Однако фаза . затвердевает в результате более сложного процесса, получившего название перитектической кристаллизации, которая включает взаимодействие между жидкостью состава C и твердым телом состава D.
Наконец, в правой части диаграммы отражен процесс эвтектической кристаллизации. В этом случае сплав общего состава E застывает с образованием однородной двухфазной смеси фазы . и граничного твердого раствора, обогащенного магнием (так называемая эвтектическая смесь), а затем затвердевает при постоянной эвтектической температуре. Если сплав содержит немного больше или меньше Mg, чем сплав E, то одна или другая из упомянутых выше фаз затвердевает первой до тех пор, пока оставшийся расплав не достигнет состава E, после чего образуется эвтектическая смесь. Результат представляет собой двухфазную смесь, состоящую (в случае избытка магния) из областей крупных зерен твердого раствора, обогащенного магнием, с вкраплениями зон мелкозернистой эвтектической смеси, так что одна и та же фаза существует в двух различных микроструктурных формах.
Верхняя часть диаграммы рис. 3 показывает оценку энергии Гиббса G при постоянной температуре 1050 К (777. С) с фазовым составом для жидкой и . . фаз. Для данного общего состава сплава устойчивой фазовой структурой всегда является структура, соответствующая более низкому значению G, за исключением тех диапазонов состава, где общая касательная к двум кривым лежит ниже обеих кривых, например диапазоны P1Q1 и P2Q2. Здесь двухфазная смесь будет иметь более низкую энергию Гиббса, чем если бы сплав состоял исключительно из одной или другой фазы. Аналогичным образом могут быть интерпретированы все части диаграммы равновесия.
Система медь - золото. Эту систему часто относят к металлургической классике.
На рис. 4 приведена часть диаграммы равновесия Cu - Au в упрощенном виде. Cu3Au представляет собой бертоллидное соединение, кристаллическая структура которого показана ниже (рис. 5,a). Когда это соединение претерпевает медленное нагревание в равновесном состоянии, оно при критической температуре TC = 390. С переходит в состояние, в котором атомы меди и золота распределены по узлам гранецентрированной кубической решетки произвольно. Это превращение называется переходом порядок - беспорядок. При дальнейшем нагревании неупорядоченная форма остается в равновесии до тех пор, пока не достигнет температуры плавления. Если соединение имеет нестехиометрический или неидеальный состав, например Cu78Au22, то TC снижается примерно до 350. С, и появляется узкая область, в которой упорядоченная и неупорядоченная формы соединения, слабо различающиеся составом, сосуществуют в равновесии.
Упорядоченная форма, например форма Cu3Au, существует потому, что имеет столько отличающихся друг от друга (Cu - Au) ближайших соседей в своей кристаллической структуре, сколько допускает эта формула. Такие соседи имеют сильные связи, заключающие в себе низкую общую энтальпию H. Переход порядок - беспорядок появляется потому, что TS в выражении G = H - TS увеличивается с ростом температуры до тех пор, пока для этого сплава не станет выгодным - в смысле энергии - беспорядок. В этом беспорядке возникает большое число однородных атомных пар (Cu - Cu и Au - Au), имеющих слабые связи, и H растет. Этот рост более чем компенсируется резким увеличением статистической энтропии, что обусловлено произвольным распределением атомов Cu и Au. Увеличение TS более чем компенсирует рост H, когда порядок в структуре уступает место беспорядку.
Хорошей аналогией описанного поведения может служить эластичность резины. Когда резиновую ленту нагревают, ее сопротивление растяжению возрастает, потому что возрастает TS. Аналогичным феноменом является исчезновение ферромагнетизма при нагревании куска железа выше его температуры Кюри; отдельные атомные магнитики в железе ведут себя во многом так же, как атомные пары Cu и Au в Cu3Au. См. также МАГНИТЫ И МАГНИТНЫЕ СВОЙСТВА ВЕЩЕСТВА
.
.
Для объяснения того, почему переход может быть резким (как в случае с Cu3Au), используются методы статистической физики - теории коллективного поведения больших совокупностей атомов. Когда достигается критическая температура, происходит нечто вроде схода лавины: чем больше атомов становятся неупорядоченными, тем легче остальные следуют за ними. Статистическая физика может придать смысл структурным переходам, предоставив информацию об относительной силе связей; однако она не может объяснить, почему связи Cu - Au прочнее связей Cu - Cu и Au - Au. Для этого необходимо применить квантовую механику. Как статистическая, так и квантовая теории имеют важное значение для исследований в современном физическом металловедении. См. также КВАНТОВАЯ МЕХАНИКА; СТАТИСТИЧЕСКАЯ МЕХАНИКА.
Если к рассматриваемому сплаву добавить больше золота, чтобы получить состав CuAu, наблюдается другой вид перехода порядок - беспорядок. Упорядоченная форма этого бертоллидного соединения показана на рис. 5,б. Упорядоченный CuAu имеет тетрагональную структуру, состоящую из последовательных слоев только Cu и только Au. Расчет показывает, что эта структура имеет больше отличающихся ближайших соседей, чем неупорядоченная (гранецентрированная кубическая) структура. Этот вид перехода порядок - беспорядок, связанный с изменением симметрии и размеров элементарной ячейки, приводит к интересным усложнениям. Указанная неупорядоченная форма имеет три равноценные оси куба, расположенные под прямыми углами друг к другу. Любая из этих осей может превращаться в тетрагональную ось c, так что одиночный неупорядоченный кристалл может превратиться в совокупность так называемых доменов, у каждого из которых есть некоторая ось c, по разному ориентированная относительно его непосредственных соседей; это схематически изображено на рис. 5,в. Поскольку ось с упорядоченного домена короче ребра куба, представляющего неупорядоченную элементарную ячейку, упорядочение вызывает локальные деформации в сплаве. Одним из следствий этого является то, что конфигурация доменов (рис. 5,в) оптимизируется таким образом, чтобы минимизировать суммарную энергию упругой деформации, так как различно ориентированные домены в какой-то степени уменьшают упругие деформации друг друга. Еще одно следствие состоит в том, что внешнее напряжение может изменять предпочтительную конфигурацию доменов, а в крайнем случае свести весь кристалл к одному домену. В современном физическом металловедении роль напряжения в определении структуры сильно возросла.
Сплавы, близкие по составу к CuAu и содержащие малые количества других благородных металлов, используются для зубных коронок и мостов. При закалке с высокой температуры такой сплав становится метастабильно неупорядоченным и, в этом состоянии, мягким. При последующем нагревании до 200-300. С он упорядочивается и принимает сложную доменную структуру, которая гораздо тверже. Такая термообработка позволяет повысить прочность зубных коронок.
Система железо - углерод. Эта система имеет важное практическое значение в промышленности. Общепринятый вариант ее фазовой диаграммы приведен на рис. 6. Эта диаграмма, для которой характерна метастабильная фаза Fe3C (цементит), соответствует сталям. В чугунах, содержащих большое количество углерода, последний выступает в виде самой устойчивой фазы, т.е. в виде элементарного углерода (графита). В сталях углерод обычно не выделяется, и вместо него появляется цементит, образование которого идет легко. Таким образом, рис. 6 дает пример диаграммы метастабильной фазы.
При термической обработке простых (т.е. железоуглеродистых) сталей существенным является то, что в зависимости от температуры они имеют две различные кристаллические структуры. При температурах немного ниже температуры затвердевания железо и растворы принимают структуру объемно-центрированной кубической решетки (дельта-фаза). При более низких температурах сталь превращается в аустенит (гамма-фаза) с гранецентрированной кубической решеткой. При еще более низких температурах происходит возврат к объемно-центрированной структуре, названной здесь альфа-фазой. (Переход от объемно-центрированной кубической решетки к гранецентрированной и обратно является уникальным для железа.) Понятие бета-железа исчезло из научного словаря, когда было осознано, что фаза, для описания которой оно предназначалось, не отражает никакого кристаллографического перехода. Фазы альфа и дельта также кристаллографически идентичны и имеют разные обозначения потому, что считались в прошлом двумя разными формами.
Когда простая углеродистая сталь, содержащая 3,6 атомов углерода на 100 атомов сплава (3,6%), медленно охлаждается, в ней происходит эвтектоидная реакция. Эта реакция сродни эвтектической реакции (см. выше), но имеет место в твердом состоянии. Получающийся продукт представляет собой смесь, называемую перлитом и состоящую из почти чистого объемно-центрированного железа (называемого ферритом) и цементита. На рис. 7,а изображен полированный и травленный шлиф перлита, как он виден под микроскопом.
Если, однако, подвергнуть аустенит закалке в воду, то перлит образоваться не успевает, а вместо него образуется структура, названная мартенситом. Это превращение не фигурирует на фазовой диаграмме, потому что мартенсит метастабилен по отношению к перлиту. На рис. 7,б представлено микрографическое изображение стали, которая была частично превращена в мартенсит. Мартенсит имеет искаженную форму объемно-центрированной кубической структуры, что делает его исключительно твердым и хрупким. При нагреве мартенсита до умеренной температуры он начинает превращаться в однородную смесь альфа-железа и цементита, становясь все более мягким и деформируемым. Это процесс отпуска - мартенситного старения. Например, высококачественному клинку или сабле придается нужная форма, когда сталь мягкая; при последующей закалке режущий край остывает очень быстро, а толстый медленнее. В результате режущая кромка становится очень твердой, а противоположный край - менее мартенситным и, следовательно, менее хрупким. Многие применяемые на практике стали представляют собой результат гораздо более сложной термической обработки, чем только что рассмотренная простая Fe - C сталь, и, кроме того, содержат другие легирующие элементы, такие, как хром, ванадий, ниобий и молибден. Эти присадки могут усиливать тенденцию образования мартенсита, благодаря чему и толстые детали допускают закалку. Каждая сталь характеризуется кривой зависимости превращения от времени и температуры (пример приведен на рис. 8), так что конструктор может получить путем термообработки любую желаемую структуру (и механические характеристики) выбранной стали. См. также МЕТАЛЛОВ ТЕРМИЧЕСКАЯ ОБРАБОТКА
.
.
До недавнего времени катаный стальной лист, который используется для изготовления автомобильных кузовов, не мог быть подвергнут термообработке, поскольку огромные рулоны листовой стали слишком велики, чтобы можно было обеспечить быстрое и контролируемое изменение температуры. Теперь после отжига такой лист подвергают холодной прокатке и затем перед свертыванием в рулон пропускают через низкотемпературную печь и устройство контролируемого охлаждения. График температура - время выдерживается с помощью компьютерного управления каждой стадией процесса. В результате такой процедуры слабо легированный стальной лист может быть доведен до стандартов прочности, однородности и профиля, которые прежде были недостижимы. В результате автомобильный кузов стал легче и прочнее.
Тройные сплавы. Тройные системы имеют соответствующие фазовые диаграммы. Известным примером может служить система Ni - Al - Fe. Тройные фазовые диаграммы включают в себя трехфазные, двухфазные и однофазные области. Таким образом, это весьма сложные структуры, требующие трехмерного графического представления посредством призмы, в основании которой лежит равносторонний треугольник. Ось призмы представляет температуру, а каждая точка основания - конкретный тройной состав. Границы фаз изображаются двумерными сечениями. Четверные системы еще сложнее и редка становятся предметом исследования; они изображаются с помощью правильного тетраэдра, в котором каждая точка представляет конкретный состав (все такие точки относятся к одной температуре).
Расчет фазовых диаграмм. Время и усилия, затрачиваемые на расчет фазовых диаграмм, особенно тройных систем, было существенно сокращено благодаря разработке вычислительных методов типа CALPHAD. Термохимические величины, такие, как теплота образования и активность твердого раствора, могут быть измерены экспериментально и затем использованы для расчета расположения границ фаз. В частности, из измерений для трех двойных систем могут быть вычислены границы фаз в соответствующей тройной системе. Этот вид расчетов является весьма плодотворным в физическом металловедении.
Диаграмма Венна
Диаграмма Венна (также используется название диаграмма Эйлера — Венна) — схематичное изображение всех возможных отношений (объединение, пересечение,
Фейнмана диаграммы
ГРАФИЧЕСКОЕ ПРЕДСТАВЛЕНИЕ МАТЕМАТИЧЕСКИХ УРАВНЕНИЙ, ОПИСЫВАЮЩИХ ВЗАИМОДЕЙСТВИЯ СУБАТОМНЫХ ЧАСТИЦ В РАМКАХ КВАНТОВОЙ ТЕОРИИ ПОЛЯ
Диаграмма Фейнмана; Фейнмана диаграммы; Фейнмановская диаграмма; Фейнмановские диаграммы; Графики Фейнмана; График Фейнмана
Фейнмана графики, графический метод теоретического анализа рассеяния частиц и др. физических процессов и вычисления их амплитуд. Предложен Р. Фейнманом в 1949, сыграл важнейшую роль в развитии квантовой электродинамики. Ф. д. нашли широкое применение в квантовой теории поля, квантовой механике и статистической физике.
Основное понятие в методе Ф. д. - функция распространения, или пропагатор. Движению частицы в квантовой теории ставится в соответствие процесс распространения волнового поля, поле же в каждой точке пространства в каждый момент времени является источником вторичных волн (принцип Гюйгенса). Пропагатор характеризует распространение такой волны между двумя пространственно-временными точками. Он является функцией этих двух точек (1 и 2) и изображается линией, их соединяющей (рис. 1). Поле в точке 2 определяется суммой волн, испущенных из всевозможных точек 1.
Взаимодействие в квантовой теории рассматривается как испускание и поглощение волн (частиц) различного типа. Например, электромагнитное взаимодействие сводится к испусканию или поглощению электронной волной (электроном) электромагнитной волны (фотона). Элементарный акт такого взаимодействия изображается графически диаграммой рис. 2, в которой прямые линии - пропагаторы электрона, волнистая - фотона. Эта диаграмма означает, что при распространении электронной волны из 1 в 2 в точке 3 появилось электромагнитное поле, испущенное в точке 4 - точке перессчения линий, называемой вершиной диаграммы. С помощью диаграммы рис. 2 как основного элемента можно построить Ф. д. для любого электродинамического процесса. Например, диаграммы рис. 3 и 4 изображают соответственно рассеяние (столкновение) электрона и фотона на электроне. Внешние линии изображают частицы (электрон или фотон) до и после столкновения, а внутренние элементы (вершины и линии) - механизм взаимодействия, который сводится на рис. 3 к излучению электромагнитной волны одним электроном и поглощению её вторым, а на рис. 4 электронной волны. Т. о., распространению волны между двумя вершинами (т. е. внутренние линии) отвечает движение соответствующей частицы в виртуальном состоянии (см. Виртуальные частицы). Одна и та же внешняя линия может изображать как начальную частицу, так и конечную античастицу (См. Античастицы) (и наоборот). Например, диаграмма рис. 4 может изображать (следует смотреть на неё не слева направо, а снизу вверх) аннигиляцию пары электрон-позитрон в два фотона.
Приведённые Ф. д. отвечают минимальному числу элементарных взаимодействий, т. е. вершин в диаграмме, приводящих к данному процессу. Но они не единственно возможные. Данный тип столкновения частиц определяется внешними линиями (начальными и конечными частицами), внутренняя же часть диаграммы может быть более сложной. Например, для рассеяния фотона электроном можно привести в дополнение к диаграмме рис. 4 Ф. д., изображенные на рис. 5, и многие другие.
На диаграммах рис. 5 электрон (падающий или виртуальный) испускает виртуальный фотон, который поглощается конечным электроном (на последней диаграмме этот фотон рождает виртуальную пару электрон-позитрон, аннигилирующую в фотон). Если взаимодействие мало, то Ф. д. рис. 5 и другие, содержащие большее число вершин, т. е. большее число элементарных взаимодействий, дадут лишь малые поправки (они называются радиационными поправками (См. Радиационные поправки)) по сравнению с вкладом основной диаграммы рис. 4, и можно ограничиться небольшим числом диаграмм. Это справедливо для квантовой электродинамики, в которой каждая дополнительная внутренняя линия вносит в амплитуду рассеяния (См. Амплитуда рассеяния) рассматриваемого процесса множитель 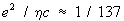 где е - заряд электрона, η - постоянная Планка, с - скорость света; поэтому квантовая электродинамика достигла высокой точности предсказаний. Если же взаимодействие не мало, то следует учитывать бесконечное число диаграмм, и это - трудность квантовой теории поля.
где е - заряд электрона, η - постоянная Планка, с - скорость света; поэтому квантовая электродинамика достигла высокой точности предсказаний. Если же взаимодействие не мало, то следует учитывать бесконечное число диаграмм, и это - трудность квантовой теории поля.
Ф. д. используются также для изображения процессов, обусловленных др. типами взаимодействий. На рис. 6 приведен распад π0-мезона; здесь пунктирная линия - π0, сплошные линии - нуклон и антинуклон (или кварк (См. Кварки) и антикварк), левая вершина - сильное взаимодействие (См. Сильные взаимодействия), волнистые линии - фотоны, а соответствующие (правые) вершины - электромагнитные взаимодействия. На рис. 7 приведён распад заряженного π-мезона; пунктирная линия - π + (π-), линии в петле - нуклон и антинуклон (кварк и антикварк), волнистая линия - гипотетический W + (W-)-meзон, переносчик слабого взаимодействия (См. Слабые взаимодействия), сплошные линии справа - мюон и нейтрино.
Каждому элементу Ф. д. - внешним линиям, вершинам, внутренним линиям соответствует некоторый множитель; поэтому, начертив ф. д., можно сразу написать аналитическое выражение для амплитуды рассеяния данного процесса.
Лит.: Швебер С., Введение в релятивистскую квантовую теорию поля, [пер. с англ.], М., 1963, гл. 14.
В. Б. Берестецкий.
Рис. 1. к ст. Фейнмана диаграммы.
Рис. 2. к ст. Фейнмана диаграммы.
Рис. 3. к ст. Фейнмана диаграммы.
Рис. 4. к ст. Фейнмана диаграммы.
Рис. 5. к ст. Фейнмана диаграммы.
Рис. 6. к ст. Фейнмана диаграммы.
Рис. 7. к ст. Фейнмана диаграммы.
Диаграммы Фейнмана
ГРАФИЧЕСКОЕ ПРЕДСТАВЛЕНИЕ МАТЕМАТИЧЕСКИХ УРАВНЕНИЙ, ОПИСЫВАЮЩИХ ВЗАИМОДЕЙСТВИЯ СУБАТОМНЫХ ЧАСТИЦ В РАМКАХ КВАНТОВОЙ ТЕОРИИ ПОЛЯ
Диаграмма Фейнмана; Фейнмана диаграммы; Фейнмановская диаграмма; Фейнмановские диаграммы; Графики Фейнмана; График Фейнмана
Диаграмма Фейнмана — графическое представление математических уравнений, описывающих взаимодействия субатомных частиц в рамках квантовой теории поля. Этот инструмент изобрёл американский физик Ричард Фейнман в конце 1940-х годов, во время его работы в Корнельском университете, для выполнения расчётов рассеяния частиц.
Физическое лицо
ЧЕЛОВЕК КАК СУБЪЕКТ ПРАВА
Физлицо; Лицо физическое; Частное лицо; Физические лица
см. Лицо физическое.
Физическое лицо
ЧЕЛОВЕК КАК СУБЪЕКТ ПРАВА
Физлицо; Лицо физическое; Частное лицо; Физические лица
Физи́ческое лицо́ (от «природа»; ) — субъект гражданского права. Как и любой другой субъект права, физическое лицо имеет права и обязанности.
ЛИЦО ФИЗИЧЕСКОЕ
ЧЕЛОВЕК КАК СУБЪЕКТ ПРАВА
Физлицо; Лицо физическое; Частное лицо; Физические лица
(в гражданском праве) , термин, употребляемый для обозначения человека (гражданина) как участника правоотношения.
Лицо физическое
ЧЕЛОВЕК КАК СУБЪЕКТ ПРАВА
Физлицо; Лицо физическое; Частное лицо; Физические лица
термин, применяющийся в законодательстве многих стран для обозначения человека как субъекта гражданских прав и обязанностей. Л. ф. противопоставляется лицу юридическому (См. Лицо юридическое) как коллективному образованию, также являющемуся субъектом права. Советское гражданское законодательство термин "Л. ф." не использует, заменив его термином "гражданин". Для участия в правоотношениях гражданин должен обладать Правоспособностью.
Диаграмма Пурбе
Диаграмма Пурбе (диаграмма преобладающих форм, E-pH диаграмма) — диаграмма, наглядно отображающая термодинамически устойчивые формы существования элементов (ионов, молекул, атомных кристаллов и металлов) в растворах при различных значениях водородного показателя pH и окислительно-восстановительного потенциала E. Предложена Марселем Пурбе.
Константа равновесия
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Википедия
Константа равновесия
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.




